-
资源简介
《T69E模拟磷酸化修饰对Bcl-2与Nur77互作的影响》是一篇探讨细胞凋亡调控机制的科研论文。该研究聚焦于Bcl-2蛋白与Nur77蛋白之间的相互作用,并通过模拟T69位点的磷酸化修饰,分析其对两者结合能力的影响。Bcl-2是细胞凋亡调控中的关键蛋白,具有抗凋亡功能,而Nur77则是一种属于孤儿核受体家族的蛋白质,在细胞应激反应和凋亡过程中发挥重要作用。两者之间的相互作用被认为在细胞命运决定中具有重要意义。
研究团队首先通过生物信息学分析,确定了Bcl-2蛋白中T69位点的保守性及其可能的磷酸化位点特征。随后,他们构建了T69E突变体,以模拟磷酸化修饰的效果。T69E突变是指将原本的苏氨酸(Threonine)替换为谷氨酸(Glutamic acid),由于谷氨酸带有负电荷,可以模拟磷酸化后的电荷状态,从而影响蛋白质的结构和功能。
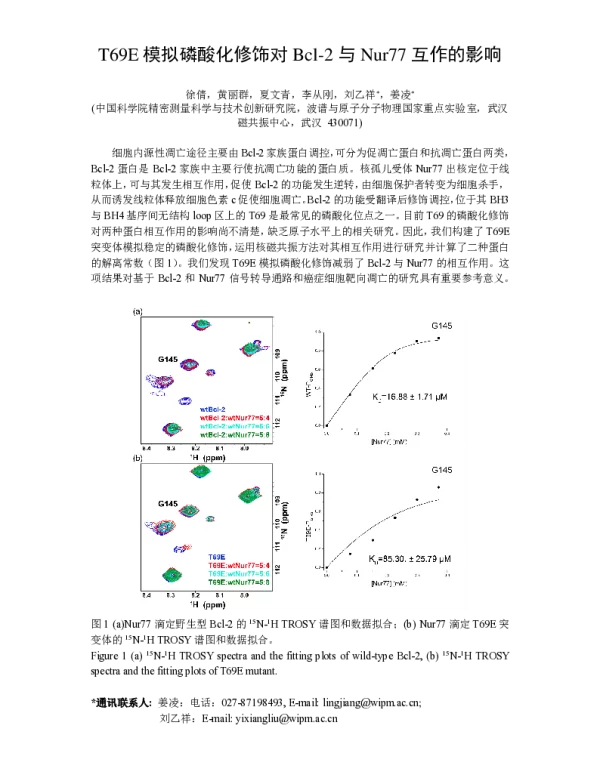
在实验部分,研究人员利用免疫共沉淀(Co-IP)技术检测了野生型Bcl-2与Nur77的结合情况,并与T69E突变体进行比较。结果显示,T69E突变显著降低了Bcl-2与Nur77的结合能力。这表明,T69位点的磷酸化可能通过改变Bcl-2的构象或电荷分布,影响其与Nur77的相互作用。
为进一步验证这一结论,研究团队还进行了荧光共振能量转移(FRET)实验,以实时监测Bcl-2与Nur77之间的距离变化。结果表明,T69E突变导致两者之间的距离增加,说明磷酸化修饰可能改变了它们的空间排列,从而抑制了相互作用。
此外,研究人员还通过细胞凋亡实验评估了T69E突变对细胞死亡的影响。他们发现,当Bcl-2发生T69E突变时,细胞对凋亡刺激的抵抗能力下降,这可能是因为Bcl-2无法有效与Nur77结合,进而削弱了其抗凋亡功能。这一结果进一步支持了T69位点磷酸化在调控Bcl-2-Nur77互作中的重要性。
为了探究T69E突变是否影响其他与Bcl-2相关的蛋白相互作用,研究团队还测试了Bcl-2与Bax、Bak等促凋亡蛋白的结合情况。结果显示,T69E突变并未显著影响Bcl-2与这些蛋白的结合,说明T69位点的磷酸化主要针对Nur77这一特定靶标。
该研究还探讨了T69位点磷酸化的潜在调控机制。通过质谱分析,研究人员发现T69E突变可能导致Bcl-2局部结构的变化,特别是与Nur77结合区域的构象改变。这种结构变化可能影响了Bcl-2表面的结合位点,从而降低与Nur77的亲和力。
研究结果不仅揭示了Bcl-2与Nur77互作的分子机制,也为理解细胞凋亡调控提供了新的视角。T69位点的磷酸化可能成为调控Bcl-2功能的重要信号,为相关疾病的治疗提供了潜在的靶点。例如,在癌症治疗中,如果能够调控Bcl-2的磷酸化状态,可能有助于增强癌细胞对凋亡的敏感性,提高治疗效果。
综上所述,《T69E模拟磷酸化修饰对Bcl-2与Nur77互作的影响》是一项具有重要意义的研究,它深入探讨了Bcl-2蛋白的功能调控机制,并揭示了磷酸化修饰在细胞凋亡过程中的关键作用。这项工作不仅丰富了我们对细胞凋亡调控网络的理解,也为相关疾病的治疗策略提供了理论依据。
-
封面预览
-
下载说明
预览图若存在模糊、缺失、乱码、空白等现象,仅为图片呈现问题,不影响文档的下载及阅读体验。
当文档总页数显著少于常规篇幅时,建议审慎下载。
资源简介仅为单方陈述,其信息维度可能存在局限,供参考时需结合实际情况综合研判。
如遇下载中断、文件损坏或链接失效,可提交错误报告,客服将予以及时处理。