-
资源简介
《应用NMR研究SHIP2-SH2识别FcgR2b-pITIM的分子机制》是一篇探讨细胞信号传导机制的重要论文。该研究聚焦于SHIP2(SH2 domain-containing inositol phosphatase 2)的SH2结构域与FcgR2b(Fc gamma receptor IIb)的pITIM(phosphorylated immunoreceptor tyrosine-based inhibitory motif)之间的相互作用。通过核磁共振(NMR)技术,研究人员揭示了这一分子识别过程的详细机制,为理解免疫调节和相关疾病提供了新的视角。
在免疫系统中,FcgR2b是一种重要的抑制性受体,其主要功能是通过结合免疫复合物来调控B细胞和巨噬细胞的活性。当FcgR2b的ITIM区域被磷酸化后,会招募具有SH2结构域的信号分子,如SHIP2,从而启动下游的抑制信号。这种信号通路对于维持免疫稳态至关重要,同时也与多种自身免疫性疾病密切相关。
SHIP2是一种含有SH2结构域的磷酸酶,能够催化磷脂酰肌醇-3,4,5-三磷酸(PIP3)的去磷酸化反应,从而抑制PI3K/Akt信号通路。这一过程对于细胞增殖、分化和存活具有重要影响。然而,SHIP2如何精确地识别并结合FcgR2b的pITIM仍然是一个未解之谜。本研究正是针对这一问题展开深入探讨。
为了研究SHIP2-SH2与FcgR2b-pITIM的相互作用,研究人员采用了核磁共振(NMR)技术。NMR是一种强大的生物物理工具,可以提供分子在溶液中的三维结构信息,并能够检测分子间的动态相互作用。通过NMR实验,研究人员获得了SHIP2-SH2与pITIM肽段结合时的构象变化数据。
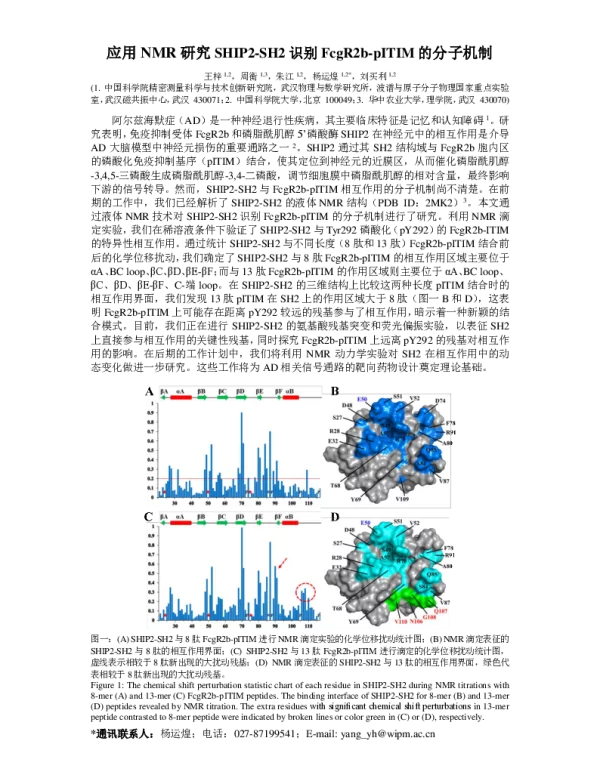
研究结果显示,SHIP2-SH2结构域能够特异性地识别FcgR2b的pITIM序列。NMR谱图分析表明,当pITIM结合到SHIP2-SH2时,其构象发生了显著变化,显示出一种特定的结合模式。此外,研究还发现,pITIM中的关键磷酸化酪氨酸残基与SHIP2-SH2的结合口袋形成了稳定的相互作用,这是实现特异性识别的关键因素。
进一步的实验表明,SHIP2-SH2与pITIM的结合不仅依赖于磷酸化酪氨酸的存在,还受到周围氨基酸序列的影响。这表明,FcgR2b的pITIM序列可能具有一定的多样性,而SHIP2-SH2可能通过识别特定的氨基酸组合来实现对不同pITIM序列的选择性识别。
除了结构分析外,研究还探讨了SHIP2-SH2与FcgR2b-pITIM结合的动力学特性。通过弛豫实验和化学交换实验,研究人员发现,这种结合过程具有一定的可逆性,并且在不同的离子强度条件下表现出不同的结合亲和力。这些结果为理解SHIP2-SH2与FcgR2b-pITIM的动态相互作用提供了重要的实验依据。
本研究的意义在于揭示了SHIP2-SH2识别FcgR2b-pITIM的分子机制,为开发靶向这一信号通路的药物提供了理论基础。同时,该研究也为理解其他SH2结构域蛋白与pITIM序列的相互作用提供了参考模型。未来的研究可以进一步探索这一机制在免疫疾病中的潜在应用,以及如何通过调控这一过程来改善免疫系统的功能。
综上所述,《应用NMR研究SHIP2-SH2识别FcgR2b-pITIM的分子机制》这篇论文通过先进的NMR技术,深入解析了SHIP2-SH2与FcgR2b-pITIM之间的分子识别机制。这项研究不仅加深了我们对免疫调节信号通路的理解,也为相关疾病的治疗提供了新的思路。
-
封面预览
-
下载说明
预览图若存在模糊、缺失、乱码、空白等现象,仅为图片呈现问题,不影响文档的下载及阅读体验。
当文档总页数显著少于常规篇幅时,建议审慎下载。
资源简介仅为单方陈述,其信息维度可能存在局限,供参考时需结合实际情况综合研判。
如遇下载中断、文件损坏或链接失效,可提交错误报告,客服将予以及时处理。